تفاوت فلز و نافلز
اگر بتواند، یک اتم الکترونها را از اتم همسایه میدزدد. همه آنها را نمیدزدد، بلکه به اندازهای برمیدارند که پایدار باشد. عناصر مختلف دارای تعداد متفاوتی از الکترونها هستند که – حداقل در تئوری – میتوانند توسط همسایهها سرقت شوند. به آنها الکترونهای ظرفیت میگویند. آنها الکترونهای بیرونی و در حال چرخش هستند که میتوانند بخشی از پیوندهای شیمیایی شوند.
تفاوت اتمهای فلزی با اتمهای غیرفلزی این است که چگونه الکترونهای ظرفیت را از اتمهای دیگر میدزدند. شاید بتوان گفت فلزات دزدهای بدی هستند. به جای گرفتن الکترونهای همسایه، معمولاً الکترونهای خود را رها میکنند. این تمایل به از دست دادن الکترونها به عنوان “خصلت فلزی” آنها توصیف میشود.
بنابراین عناصر غیرفلزی دارای ویژگی فلزی کمی هستند. از جمله این نافلزات میتوان به کربن، اکسیژن و نیتروژن اشاره کرد. وقتی صحبت از سارقان الکترون به میان میآید، نافلزات بهترین هستند. پادشاه این نافلزات فلوئور است. وقتی صحبت از سرقت الکترون به میان میآید، فلوئور یک قلدر واقعی است. بنابراین بسیار واکنشپذیر است.
فلزات میل به الکترون دارند، اما فقط ضعیف. با این حال، از بسیاری جهات، این ضعف به عنوان نقطه قوت فلزات ظاهر میشود. چکش خواری (خم شدن)، شکل پذیری (کشش) و رسانایی آنها ناشی از تمایل این عناصر به از دست دادن الکترون است.
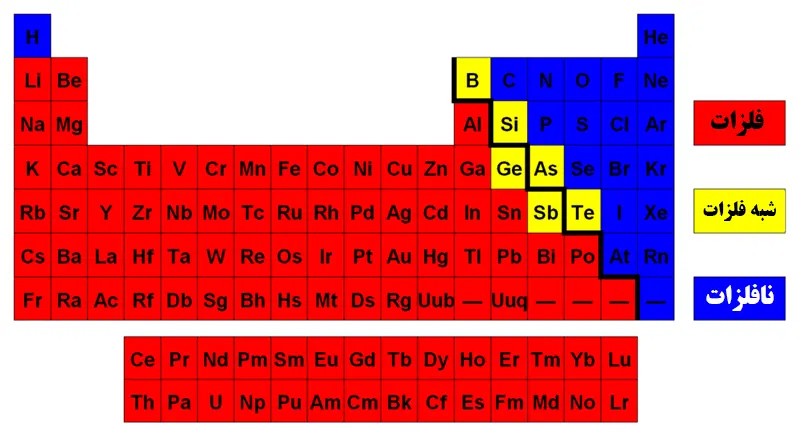
فلزات گاهی اوقات به عنوان شبکهای از یونهای مثبت توصیف میشوند که توسط ابری از الکترونهای غیرمحلی احاطه شدهاند. فلزات یکی از سه گروه از عناصر هستند که با خواص یونیزه شدن و پیوند، همراه با فلزات و نافلزات متمایز میشوند. در جدول تناوبی، یک خط مورب که از بور (B) به پلونیوم (Po) کشیده شده است که فلزات را از نافلزات جدا میکند. عناصر موجود در این خط متالوئید هستند که گاهی اوقات شبه فلز نامیده میشوند. عناصر سمت چپ پایین، فلز هستند. عناصر سمت راست بالا نافلز هستند.